5'-三磷酸腺苷(ATP)是生命活动能量的直接来源,也是生物体中调节多种生物通路的关键分子。许多工业化应用潜在生物催化剂的活性也依赖于ATP,如连接酶、激酶和合成酶等。因此对于这些酶的生物转化过程开发一种稳定、廉价、高效的ATP再生系统显得尤为重要。
多聚磷酸激酶(PPK) 参与聚磷酸链(PolyP)的聚合或降解,可分为PPK1和PPK2两大家族。其中PPK1类酶主要催化ATP末端磷酸降解并可逆聚合形成PolyP。PPK2类酶优先催化PolyP驱动的ATP、ADP或GTP的合成。PPK2类酶又分为三类(I、II和III),I类催化ADP磷酸化为ATP, II类催化AMP磷酸化为ADP。而III类酶对这两种底物都具有活性,能够分别将AMP磷酸化为ADP和ADP磷酸化为ATP,可以实现一个酶催化从AMP到ATP再生,因此在生物催化反应中应用更为广泛。来自Cytophaga hutchinsonii PPK(ChPPK)就属于PPK2III类,是目前论文报道使用最多的ATP再生激酶。但是该酶的活力、稳定性、底物耐受性等属性还无法满足工业催化的要求,故本研究用半理性策略对ChPPK进行改造。
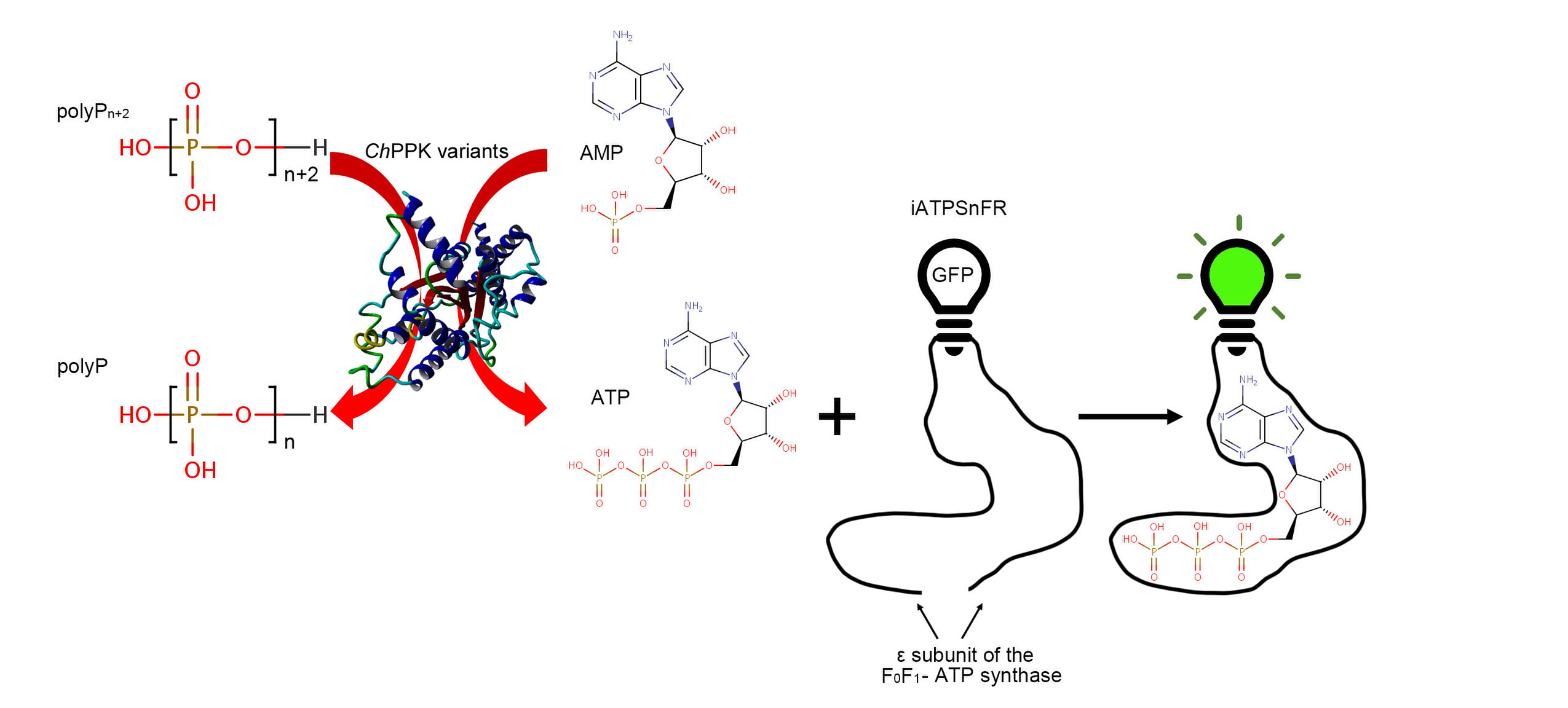
图1 基于ATP荧光反应的PPK高通量检测系统原理
课题组首先构建了基于GFP的基因编码单波长传感器(iATPSnFR)的ATP高通量检测方法。通过高通量对ChPPK的16个关键残基进行了饱和诱变。在筛选了约4800个菌落后,9个单氨基酸变异比野生型ChPPK的活性增加了3倍以上(图2)。有益突变重组产生的四重变体(ChPPK/A79G/S106C/I108F/L285P) 与野生型ChPPK相比活性增强了18.1倍(图3)。该突变体ChPPK/A79G/S106C/I108F/L285P在磷酸核糖基焦磷酸合成酶和烟酰磷酸核糖基转移酶的催化下合成烟酰胺单核苷酸的反应中提供ATP再生,产量比野生型ChPPK提高了约3倍。综上所述,改造后的突变体ChPPK/A79G/S106C/I108F/L285P有望在依赖ATP的生物催化反应中得到广泛应用。
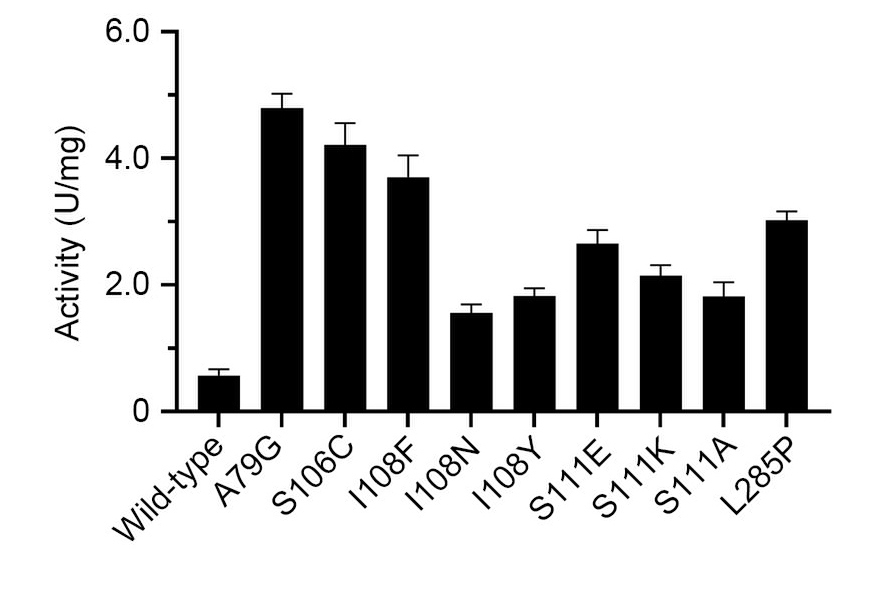
图2 PPK单点突变体再生ATP的活力比较
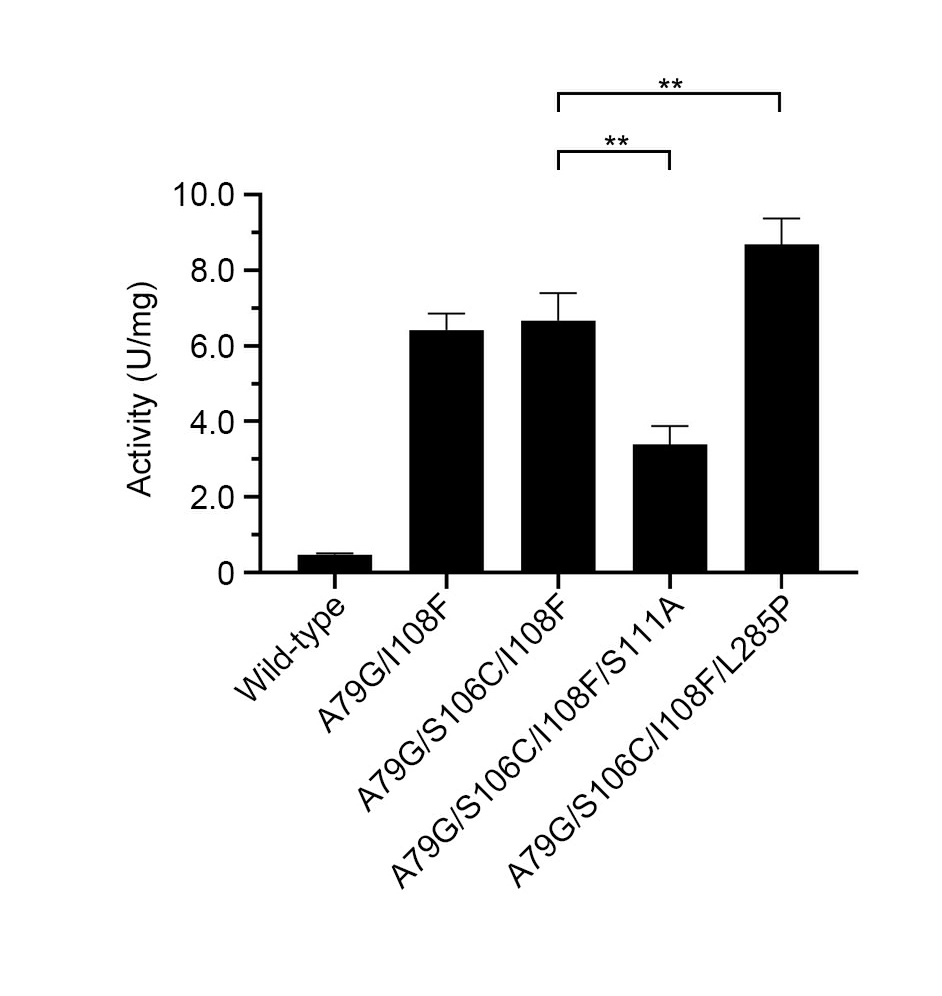
图3 PPK组合突变体再生ATP的活力比较
相关工作以“Semirational engineering of Cytophaga hutchinsonii polyphosphate kinase for developing a cost-effective, robust, and efficient adenosine 5′-triphosphate regeneration system”为题发表在《Applied and Environmental Microbiology》。薛亚平教授团队副教授沈其为第一作者,2020级硕士研究生张诗嘉为本课题做出了贡献。研究得到了国家重点研发计划、浙江省国家自然科学基金重大研究计划、浙江高校基本科研业务费资助。
论文信息:Shen, Q.; Zhang, S.J.; Xu, B.H.; Chen, Z.Y.; Peng, F.; Xiong, N.; Xue, Y.P.; Zheng, Y.G., Semirational engineering of Cytophaga hutchinsonii polyphosphate kinase for developing a cost-effective, robust, and efficient adenosine 5'-triphosphate regeneration system. Applied and environmental microbiology, 2023, e0110623.
论文链接:https://doi.org/10.1128/aem.01106-23