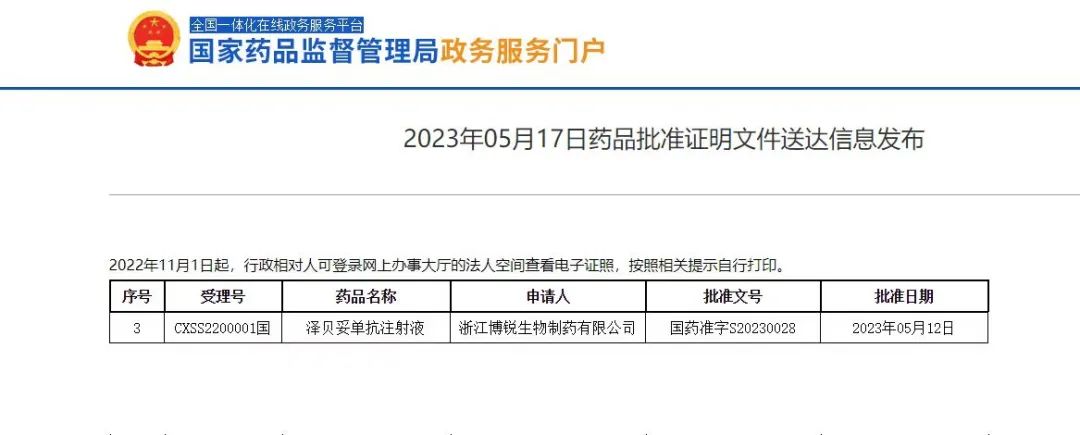
5月17日,校友企业浙江博锐生物制药有限公司(以下简称“博锐生物”)宣布,其自主研发的1类创新型治疗用生物制品泽贝妥单抗注射液(商品名:安瑞昔?)正式获国家药品监督管理局(NMPA)批准上市(国药准字S20230028),适应症为CD20阳性弥漫大B细胞性淋巴瘤(DLBCL)。这是博锐生物首款1类创新型生物药获批上市,也是浙江省首个创新单抗药物。自此,博锐生物正式迈入以安佰诺?(注射用重组人II型肿瘤坏死因子受体-抗体融合蛋白)、安健宁?(阿达木单抗注射液)、安佰特?(注射用英夫利西单抗)、安舒正?(枸橼酸托法替布片)、安瑞泽?(注射用曲妥珠单抗)、安瑞昔?(泽贝妥单抗注射液)为核心的“六安”时代,也为淋巴瘤患者提供了治疗新希望。
淋巴瘤作为常见的恶性肿瘤之一,每年新发患者约10万[1],其中B细胞非霍奇金淋巴瘤是最常见的类型之一。值得注意的是,近年来B细胞非霍奇金氏淋巴瘤发病人数和死亡人数均逐年递增[2]。以利妥昔单抗为基础的方案是当前治疗B细胞淋巴瘤的基石,但仍有约40%的患者经过初始标准治疗后会发展为复发/难治型,因此,临床上急需完全缓解率更高、无进展生存期更长的治疗方案。安瑞昔?作为一款靶向CD20的生物制剂,为以DLBCL为代表的B细胞淋巴瘤患者提供了新的选择。临床前研究数据表明,相比于其它产品,安瑞昔?抗体介导的细胞毒性效应(ADCC)更强,同时具有更大的稳态分布容积,能够对B细胞产生更持久的清除作用,从而发挥更好的药物作用。同样,其积极结果也体现在III期临床研究之中,安瑞昔?III期临床研究辐射全国43个研究中心,共计招募487例受试者,是一项随机、双盲、阳性药对照临床研究。
各项研究结果均表明,安瑞昔?和美罗华?相比结构得到了进一步优化,在两药安全性及免疫原性相当的情况下,安瑞昔?具有更强的抗肿瘤潜力和更高的完全缓解率,临床疗效更优。2年随访数据也显示出安瑞昔?相比美罗华?而言,能降低复发和死亡风险。
据弗若斯特沙利文报告分析,中国抗CD20单抗市场将以21.9%的年复合增长率稳步前进,由2018年的25.2亿元将增长至2023年的67.8亿元。预估未来将以6.7%的年复合增长率于2030年达到106.9亿元。作为国产1类CD20治疗用生物制品,安瑞昔?将成为博锐生物继安瑞泽?后又一款重磅产品,市场潜力值得期待。此外在适应症方面,安瑞昔?针对自免领域的原发免疫性血小板减少症(ITP)开展了临床研究,有望为 ITP患者提供更多治疗选择。
博锐生物CEO、2004届生物化工专业校友王海彬博士表示:“近年来淋巴瘤规范化诊疗在科研人员的努力之下已有长足进步,一些进展如CD20单抗、免疫检查点抑制剂的应用等也取得了相应的成果。我们很欣慰的看到越来越多的患者能够从中受益,也很高兴博锐生物能够加入其中,为提高药物可及性、延长生存期及提供更多样化的诊疗方案尽一臂之力。安瑞昔?作为公司第六款上市产品,也是公司首款肿瘤免疫领域新药,在这里程碑的时刻特别感谢参加该产品临床研究人员、合作伙伴及博锐生物的同事们付出的巨大努力。未来,博锐生物将深耕免疫领域,专注未被满足的医疗需求,为临床提供更多诊疗选择,为患者带来更多医疗解决方案。”
参考文献:
[1] 中国临床肿瘤学会(CSCO)抗淋巴瘤联盟, 中国临床肿瘤学会(CSCO)抗白血病联盟. 白血病·淋巴瘤,2020,29 (02): 65-72.
[2] 林晓媛, 张晓冬. 利妥昔单抗联合CHOP化疗方案治疗B细胞非霍奇金淋巴瘤的临床观察 [J] . 中国实用医刊, 2022, 49(4) : 93-96. DOI: 10.3760/cma.j.cn115689-20211030-03726.