氟烷基基团的掺入已成为药物化学的重要工具,增强了药物分子的性质,如亲脂性、生物利用度、结合选择性和代谢稳定性,最终对治疗结果产生重大影响。近几十年来,全氟烷基,特别是三氟甲基(CF3)基团作为烷基取代后期修饰的有效生物电子等排体获得了越来越多的关注。因此,构建含三氟甲基的有机氟化合物的发展已成为化学家研究的一个重要焦点。然而,传统的有机合成方法在对三氟甲基化反应的立体选择性控制方面面临巨大挑战,尤其是在合成高纯度的C(sp3)–CF?化合物时。近年来,生物催化在促进高价值化合物的对映选择性合成方面发挥着越来越重要的作用。浙江工业大学生物工程学院徐鉴课题组开发了一种基态黄素依赖酶催化的自由基介导的不对称三氟甲基化策略,为解决该挑战提供了新的方法。
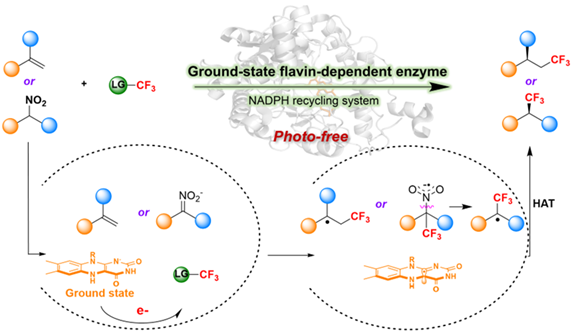
图1. 基态黄素依赖型酶催化的不对称自由基三氟甲基化反应
本研究以TT-CF3+OTf-试剂作为自由基供体,实现了不对称自由基加成反应以及不对称亲电交叉偶联反应:通过筛选多种黄素依赖性酶,不对称自由基加成反应在烯还原酶OYE1催化下,提供了具有较高非对映选择性(94:6 e.r.),产物产率可达72%。对于不对称交叉亲电偶联反应,烯还原酶GluER为最优催化剂,提供了具有非对映选择性(69:31 e.r.),产物产率可达60%。为了进一步提高反应立体选择性和产率,我们进行蛋白质改造,在聚焦理性迭代突变的策略下,构建突变文库,筛选最优突变株,进一步提高反应活性以及立体选择性。

图2. 反应活性以及立体选择性的优化
在最优条件下,研究人员同时对自由基加成反应以及亲电交叉偶联反应的底物适用范围进行了考察,反应具有良好的兼容性。考虑到全氟烷基链的重要性,我们使用TT-C4F9+X-(X= OSO2C4F9)成功将该反应扩展至全氟丁基化。

图3. 底物扩展
研究人员通过紫外可见光谱实验和计算模拟对反应的机制进行了解析。自由基捕获实验以及同位素标记实验支持了自由基反应历程以及反应的HAT淬灭机制:反应的起始是通过基态黄素醌基团(FMNhq)单电子转移(SET)启动,最终通过黄素半醌(FMNsq)完成氢原子转移(HAT)来“淬灭”自由基反应,保证了反应的精确控制。

图4. 反应机理
这一新的催化策略不仅提供了一个高效的三氟甲基化合成方法,同时也为解决传统有机氟化反应中的立体选择性难题提供了可行的解决方案。相关研究成果以“Ground-state flavin-dependent enzymes catalyzed enantioselective radical trifluoromethylation”为题,发表于《Nature Communications》。我院徐鉴教授和杭州师范大学王志国副研究员为论文的通讯作者,段鑫宇博士为该论文的第一作者,博士研究生崔栋以及硕士研究生王梦迪为共同一作。研究得到了国家自然科学基金(No. 22322705, 22171243, 22301276)、国家重点研发计划(No.2021YFC2102000)、以及浙江省自然科学基金(LQ24B020009)等项目的支持。
文章链接:https://doi.org/10.1038/s41467-025-56437-1


